2023年3月23日,我校季勇教授团队在心血管领域权威期刊《循环》(Circulation)在线发表了题为《内皮HDAC1-ZEB2-NuRD复合物通过调控蛋白巯基硫化修饰促进主动脉瘤及主动脉夹层发生》“Endothelial HDAC1-ZEB2-NuRD Complex Drives Aortic Aneurysm and Dissection Through Regulation of Protein S-Sulfhydration”的研究论文,首次揭示了CSE/H2S体系介导的蛋白质巯基硫化修饰在内皮功能稳态及AAD中发挥核心保护作用,并发现了HDAC1-ZEB2-NuRD 复合体介导CSE表达的表观调控新机制。同时,团队发现了H2S供体GYY4137和HDAC1抑制剂恩替诺特对主动脉瘤/夹层的防治作用。

主动脉瘤/夹层(Aortic Aneurysm and Dissection, AAD)是一类大血管病变,致死致残率高,严重威胁患者生命健康。近年有研究显示内膜重建或修复内皮细胞间紧密连接,能够降低AAD的发生率,提示内膜完整性在对抗AAD中发挥关键作用。然而,AAD过程中,维持内皮细胞功能稳态的关键机制仍不清楚。硫化氢(H2S)是维持血管稳态的重要气体信号分子,在心血管系统中,H2S主要由胱硫醚-γ-裂解酶(CSE)催化合成。H2S通过多种途径参与调控细胞功能,近年来研究发现其介导的蛋白巯基硫化修饰可能是发挥作用的共同内在机制。然而CSE/H2S系统介导的蛋白质巯基硫化修饰在内皮功能稳态及主动脉瘤/夹层中的作用尚不清楚。
研究人员从临床样本出发,发现较高血浆H2S水平与较低夹层发生风险相关。随后从细胞和动物水平明确了内皮细胞CSE/H2S系统在AAD中的关键作用。CSE/H2S系统功能障碍通过降低PDI第343和400位点的巯基硫化修饰,诱导内质网应激和内皮损伤,促进主动脉瘤/夹层的发生。此外,研究团队发现HDAC1-ZEB2-NuRD 复合物调控CSE表达的新机制。在此基础上,团队验证了针对关键节点的小分子化合物GYY4137和恩替诺特在防治AAD中的疗效。
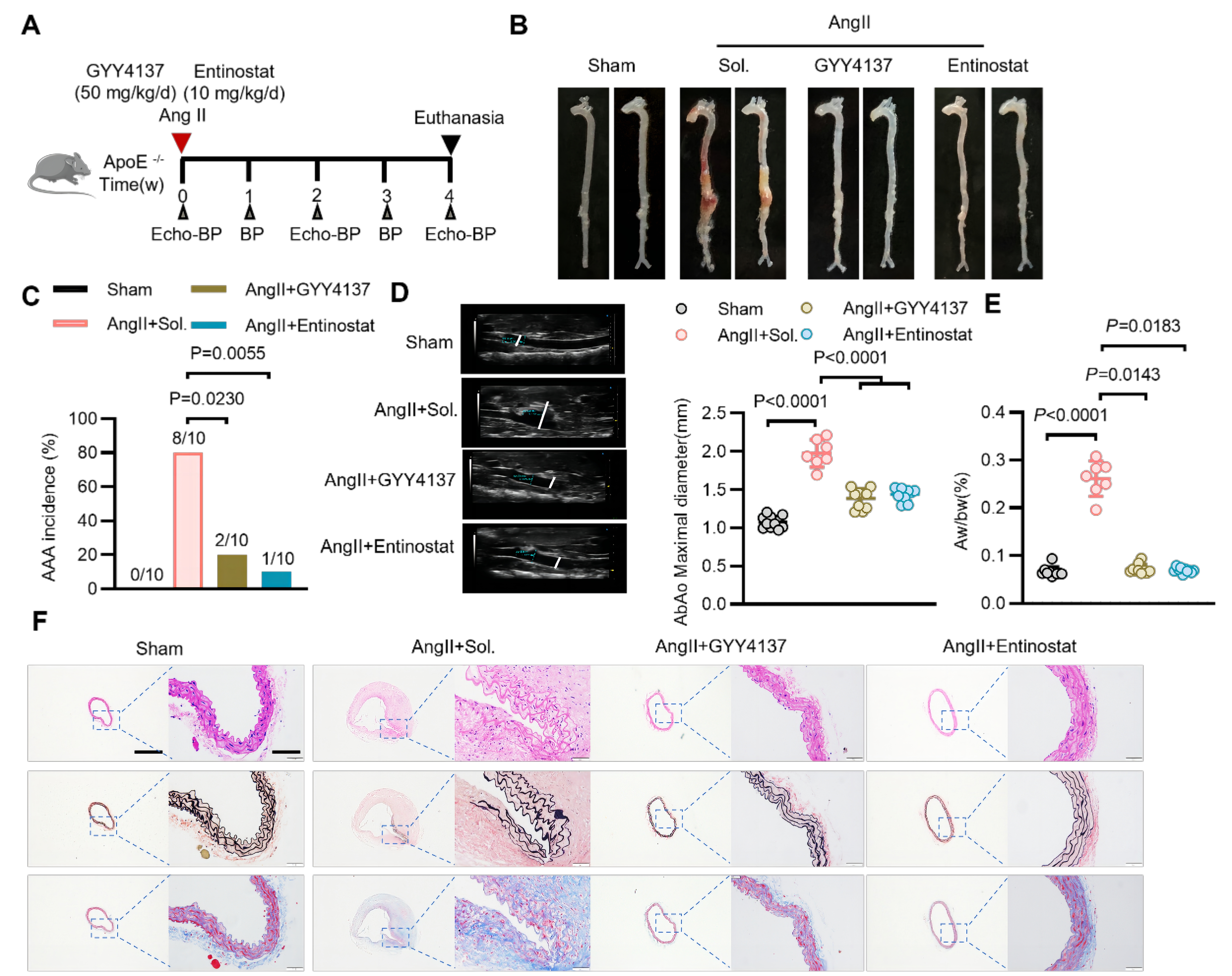
该研究从临床,动物和细胞水平阐明了内皮CSE/H2S系统在AAD中的关键作用,发现了CSE转录调控的新机制,并发现了对AAD有潜在治疗作用的候选药物分子,为AAD的防治提供了新的思路。
南京医科大学药学院心脑血管药物重点实验室罗姗姗副教授,孔垂玉博士,赵爽副教授和唐欣副教授为该论文的共同第一作者。我校季勇教授,谢利平教授,与南京医科大学第一附属医院韩艺教授及美国天普大学王虹教授为该论文的共同通讯作者。感谢南京医科大学生殖医学国家重点实验室顾爱华教授,南京医科大学基础医学院法医学系陈峰教授,中国科学院上海营养与健康研究所荆清教授,哈尔滨医科大学心肌缺血教育部重点实验室张志仁教授以及南京鼓楼医院心胸外科主任王东进教授等对本研究的大力支持。
该项研究获得国家自然科学基金创新研究群体及重点国际(地区)合作研究项目、科技部重点研发计划等项目的资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/36951067/
(撰稿/罗姗姗 ;审核/韩峰)


