近日,徐华娥教授团队与合作者团队在国际权威期刊Advanced Functional Materials (中科院1区,IF=19.924)在线发表了最新研究成果“Promote Intratumoral Drug Release and Penetration to Counteract Docetaxel-Induced Metastasis by Photosensitizer‐Modified Red Blood Cell Membrane-Coated Nanoparticle”(https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202212109)。南京医科大学2022级博士研究生吴庭和上海药物所博士后郎天群为论文的共同第一作者,徐华娥教授、中国科学院上海药物研究所李亚平研究员、尹琦研究员为论文的共同通讯作者,南京医科大学为本文第一通讯单位。
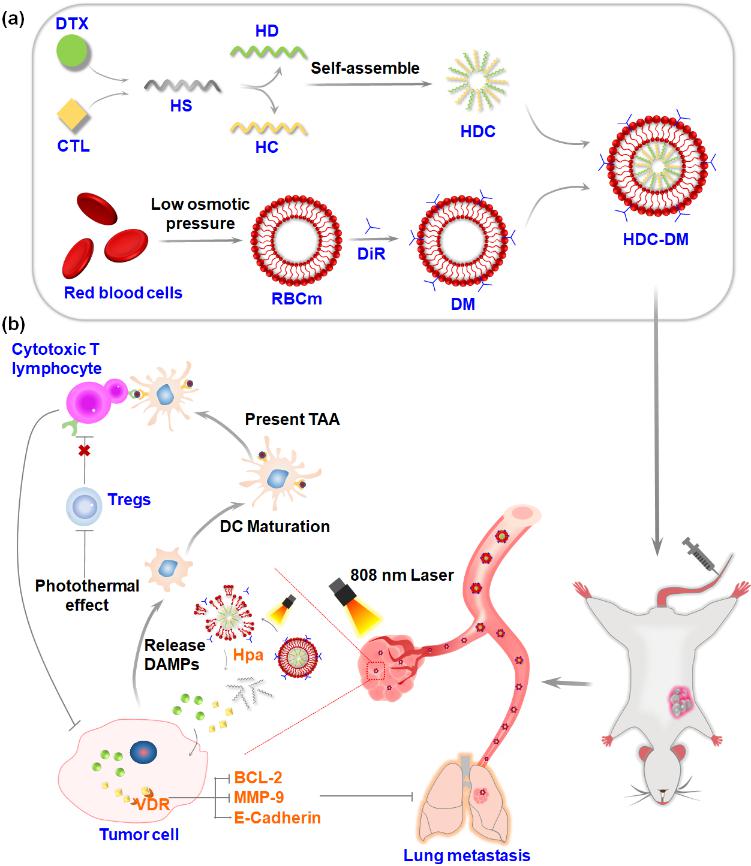
紫杉烷类药物是三阴性乳腺癌一线治疗方案,但是临床应用一直存在响应率较低、毒副作用大、易诱发肿瘤转移等问题。研究发现骨化三醇与化疗药物联用可对抗药物所引起的肿瘤转移,但是有效剂量的普通骨化三醇注射给药后易导致严重的高钙血症等毒副作用。因此,化疗药与骨化三醇的联用亟需新的递药策略,来提高靶部位药物浓度、降低毒副作用。针对上述问题,团队联合上海药物所设计了一种光-酶双响应性仿生纳米粒(HDC-DM),用于共递送紫杉烷类药物多西他赛和骨化三醇。结果表明,HDC-DM可有效延长药物体内循环时间,提高药物在肿瘤部位的蓄积,显著抑制肿瘤生长及肺部转移灶的形成。同时有效改善体重下降、高钙血症等毒副作用。该研究为多种疗法联用治疗三阴性乳腺癌以及药物的体内递送提供了新的思路。
该研究得到了国家自然科学基金、南京医科大学高层次人才启动基金等项目的资助。
徐华娥教授团队多年来致力于开发以临床问题为导向的智能靶向药物递送体系并将其应用于肿瘤、心脑血管等重大疾病,通过运用高分子、自组装、仿生递送以及微环境响应性水凝胶等材料构建递送体系实现了免疫调控药物、基因药物、分子靶向药物、化疗药物以及中药单体等的成功递送,为疾病治疗提供了新思路、新方法。相关工作分别发表于Adv Mater、Adv Funct Mater、Mater Today Bio、ACS Appl Mater Interfaces等国际知名期刊上。下面为团队近年研究成果速览:
一、肿瘤免疫与放射治疗药物递送体系构建及评价
1.1 Advanced Functional Materials:免疫刺激原位水凝胶改善恶性胶质母细胞瘤切除后复发的协同放射免疫治疗
胶质母细胞瘤(GBM)患者术后易复发是临床上一个非常棘手的问题。团队与合作者基于GBM微环境特点设计了一种可注射的、可降解活性氧的治疗性水凝胶载药体系 (ADU-AAV-PD1@Gel),能够持续局部释放可溶性 PD-1和干扰素基因刺激蛋白(STING)激动剂 ADU-S100。该体系与放疗相结合,能够持续性提高T细胞浸润,恢复T细胞的功能,从而产生强大的抗肿瘤免疫反应,显著抑制肿瘤生长并防止GBM复发,为GBM的治疗提供了一种新的思路。
Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Adv Funct Mater, 2022, 2205038. DOI: 10.1002/adfm.202205038.
1.2 Materials Today Bio:负载姜黄素自组装纳米纤维通过抑制MDSCs靶向调控肿瘤微环境
骨髓源性抑制细胞(MDSCs)是肿瘤微环境(TME)的关键参与者,在免疫抑制方面发挥着重要作用。本研究中姜黄素(Cur)被作为一种特异性的MDSCs抑制因子来抑制MDSCs的数量和功能。团队与合作者将Cur与自组装肽相结合,制备了一种新型的自组装纳米纤维体系Nano-Cur,可明显改善TME的免疫状态,促进炎症介质如GM-CSF和IL-6的生成,抑制MDSCs在TME中的募集,为肿瘤免疫治疗提供了新思路。
Targeted regulation of tumor microenvironment through the inhibition of MDSCs by curcumin loaded self-assembled nano-filaments. Mater Today Bio, 2022, 15: 100304. DOI: 10.1016/j.mtbio.2022.100304.
1.3 Advanced Functional Materials:姜黄素超分子纳米纤维高效增敏肿瘤放疗
术前放化疗可以有效缩小局部肿瘤体积,而肿瘤放疗抵抗是放疗失败的主要原因。迄今为止,研究人员一直在寻找有效的放疗增敏剂。团队与合作者首次将超分子纳米材料作为载体,借助自组装短肽开发出姜黄素超分子纳米纤维(Cur-SNF)放疗增敏剂。Cur-SNF能够通过有效抑制因放疗诱导的NF-κB信号通路的活化从而增强放疗敏感性,为肿瘤放疗增敏提供了新的策略。
Supramolecular nanofibers of curcumin for highly amplified radiosensitization of colorectal cancers to ionizing radiation. Adv Funct Mater, 2018, 28: 1707140. DOI:10.1002/adfm.201707140.
1.4 Advanced Materials:线粒体特异性靶向AIE分子作为放疗增敏剂增敏肿瘤放疗
放疗主要是通过作用于线粒体引起肿瘤细胞凋亡,因此线粒体在增强肿瘤细胞对放疗敏感性方面起着至关重要的作用。研究表明,活性氧引起的线粒体膜通透性改变能够增敏肿瘤放疗。团队与合作者开发了一种能够诱导细胞产生单线态氧的线粒体靶向AIE分子DPA-SCP,从而提高了肿瘤细胞对放疗的敏感性,产生“0 + 1> 1”的协同抗肿瘤作用,为肿瘤放疗增敏提供了新的思路。
Mitochondrion-anchoring photosensitizer with aggregation-induced emission characteristics synergistically boosts the radiosensitivity of cancer cells to ionizing radiation. Adv Mater, 2017, 29: 1606167. DOI: 10.1002/adma.201606167
二、肿瘤化疗增敏体系构建及评价
2.1 ACS Applied Materials & Interfaces:共载紫杉醇和汉防己甲素的新型“无载体”纳米纤维共给药系统通过促进线粒体凋亡发挥协同抗肿瘤活性
紫杉醇(Ptx)是胃癌,尤其是手术无法切除的局部晚期、复发或转移性胃癌治疗方案中不可或缺的重要组成部分。团队前期发现汉防己甲素(Tet)能够增强Ptx的抗肿瘤效果,但较差的水溶性限制了二者的联合用药。而基于“无载体纳米药物”概念的新型超分子纳米材料被认为是协同给药的可行方案之一。团队与合作者构建了以Ptx-SA-RGD为药物载体的“无载体”纳米纤维,获得了共负载Ptx和Tet的纳米纤维递送系统(P/T-NFs)。结果表明该递送系统具有更强的抗肿瘤效果。该工作将进一步推动Ptx的临床应用。
Novel “carrier-free” nanofiber codelivery systems with the synergistic antitumor effect of paclitaxel and tetrandrine through the enhancement of mitochondrial apoptosis. ACS Appl Mater Interfaces, 2020, 12: 10096-10106. DOI: 10.1021/acsami.9b17363.
2.2 Materials Chemistry Frontiers:基于AIE分子的光动力治疗协同紫杉醇通过诱导凋亡发挥协同抗肿瘤活性
光动力治疗(PDT)具有可控性强、对肿瘤等病灶活性强、对正常组织毒性小等特点。团队与合作者将PDT光敏剂——聚集诱导发光(AIE)分子TPE-py作为化疗增敏剂使用,成功实现了PDT增敏化疗,推动了Ptx以及PDT在肿瘤化疗领域的的应用。
Photodynamic antitumor activity of aggregation-induced emission luminogens as chemosensitizers for paclitaxel by concurrent induction of apoptosis and autophagic cell death. Mater Chem Front, 2021, 5: 3448-3457. DOI: 10.1039/d1qm00089f.
三、肿瘤光动力/光声/光热治疗体系构建及评价
3.1 ACS Applied Materials & Interfaces:基于聚集诱导发光分子的光动力疗法协同NF-κB信号通路抑制剂通过克服肿瘤缺氧发挥抗肿瘤活性
PDT是一种很有前途的癌症治疗方法,但肿瘤乏氧以及光的组织渗透性差等原因严重限制了其治疗效果。团队利用协同给药的方式构建了一种基于AIE分子的多级给药体系,实现了协同增强的光动力消除肿瘤效果。该研究为肿瘤的光动力治疗提供了新思路。
Aggregation-induced emission photosensitizer synergizes photodynamic therapy and inhibition of the NF-κB signaling pathway to overcome hypoxia in breast cancer. ACS Appl Mater Interfaces, 2022, 14: 29613-29625. DOI: 10.1021/acsami.2c06063.
3.2 ACS Applied Materials & Interfaces:含方酸的愈创木薁类化合物用于肿瘤光声成像和光热治疗
光声成像(PAI)指导下的光热疗法(PTT)可以同时实现对肿瘤的实时诊断和原位治疗。团队与合作者设计合成了Az-SQ-1和Az-SQ-2两种光热转化剂,并以DSPE-PEG作为载体,构建得到了光热转化性能优越且生物安全性较高的纳米递送体系并获得了良好的肿瘤诊疗效果。
Azulene-containing squaraines for photoacoustic imaging and photothermal therapy. ACS Appl Mater Interfaces, 2022, 14: 19192-19203. DOI: 10.1021/acsami.2c02308.
四、中药单体仿生递送体系构建及评价
4.1 Asian Journal of Pharmaceutical Sciences:联合应用iRGD增强红细胞膜仿生的白藜芦醇纳米微球治疗结直肠癌
白藜芦醇(RSV)是一种可以通过“多靶点,多机理”发挥疾病治疗的中药小分子单体,已被证明具有抗结直肠癌效果,但水溶性差、生物利用度低等问题限制了其在临床上的运用。基于细胞膜仿生技术的纳米药物递送系统由于具有良好的生物相容性以及低免疫原性等优点而备受关注。团队与合作者构建了肿瘤靶向肽iRGD与红细胞膜仿生RSV共递送的纳米递药体系,并首次发现了该体系可以通过铁死亡途径发挥抗结直肠癌活性,为结直肠癌的治疗提供了新的策略。
Ferroptosis-induced anticancer effect of resveratrol with a biomimetic nano-delivery system in colorectal cancer treatment. Asian J Pharm Sci, 2022, 17: 751-766. DOI: 10.1016/j.ajps.2022.07.006.
4.2 Cancers:仿生红细胞膜介导的熊果酸纳米粒靶向治疗非小细胞肺癌
非小细胞肺癌占所有肺癌病理分型的85%,对多种治疗方案耐受,患者预后差。研究表明熊果酸具有显著的抗肿瘤活性,但是水溶性差且具有毒副作用,因此临床应用受到限制。团队与合作者开发了一种仿生红细胞膜包覆型熊果酸纳米粒(UMNPs),能够逃避单核巨噬系统对药物的清除,并靶向肿瘤部位,进一步提高了其抗肿瘤效果,为中药小分子治疗非小细胞肺癌提供了新思路。
Biomimetic red blood cell membrane-mediated nanodrugs loading ursolic acid for targeting NSCLC therapy. Cancers, 2022, 14: 4520. DOI: 10.3390/cancers14184520.
4.3 European Journal of Pharmacology:iRGD功能化红细胞膜包载的淫羊藿苷纳米粒增强抗肿瘤效果
淫羊藿苷(ICA)是一种中药小分子单体,具有较强的抗肿瘤作用。然而,水溶性差和肿瘤组织浸润度低等缺点限制了其在临床中的应用。团队与合作者构建了一种iRGD功能化仿生纳米靶向递送体系,改善了ICA的水溶性和生物相容性,进一步提高了ICA的抗肿瘤效果。
Enhanced antitumor effect of icariin nanoparticles coated with iRGD functionalized erythrocyte membrane. Eur J of Pharmacol, 2022, 931: 175225. DOI10.1016/j.ejphar.2022.175225.
徐华娥教授个人简介:

徐华娥,南京医科大学药学院药剂学系主任、特聘教授、博导,江苏省“333”工程培养对象,江苏省卫健委青年医学人才。2014-2016年美国MD安德森癌症中心放射肿瘤学系高级访问学者。2019年2月作为南京医科大学高层次引进人才受聘于药学院。
在此感谢国家自然科学基金委员会、南京医科大学人才办公室、南京医科大学药学院以及各合作单位对本课题组工作的支持和帮助!
