2024年3月13日,我院江苏省心脑血管药物重点实验室陈宏山教授课题组在Acta Pharmaceutica Sinica B(中科院一区,IF=14.5)发表题为 《ASF1A-dependent P300-mediated histone H3 lysine 18 lactylation promotes atherosclerosis by regulating EndMT》的研究论文。该研究论文通讯作者为南京医科大学药学院心脑血管药物重点实验室陈宏山教授,季勇教授(南京医科大学/哈尔滨医科大学)和南京医科大学第一附属医院(江苏省人民医院)心脏大血管外科邵永丰教授。第一作者为2021级硕士研究生董梦蝶,张韵佳和陈明红。

血管内皮功能损伤是动脉粥样硬化(AS)的重要起始因素。内皮-间充质转化(endothelial-to-mesenchymal transition,EndMT)时内皮细胞在多种刺激下逐渐失去内皮特征,向间充质细胞转化。EndMT的异常发生是内皮功能紊乱和动脉粥样硬化的关键驱动因素,其潜在表观调节机制研究较少。
课题组发现脂质过氧化可通过刺激血管内皮细胞有氧糖酵解异常升高导致乳酸积聚,增加组蛋白H3K18乳酸化(H3K18la)。组蛋白伴侣ASF1A和组蛋白修饰酶P300协同调控组蛋白H3K18乳酸化修饰,调控SNAI1启动子H3K18la富集状态,从而激活EndMT转录因子SNAI1的表达,诱导EndMT发生,促使内皮功能紊乱。功能实验证实H3K18la参与了AS,并发现内皮特异性敲除ASF1A可抑制EndMT并缓解AS的发展。通过药物抑制和PROTAC技术抑制糖酵解可有效降低斑块面积从而缓解EndMT诱导的AS。本研究发现在EndMT诱导AS过程中,代谢和表观遗传学通过P300/ASF1A分子复合物调控H3K18la影响EndMT关键分子染色质微环境,组蛋白乳酸化在EndMT诱导的AS中发挥关键作用,为临床治疗AS提供了新的靶点和治疗策略。
该项研究工作得到了国家自然科学基金面上项目和青年项目等多项资金支持。
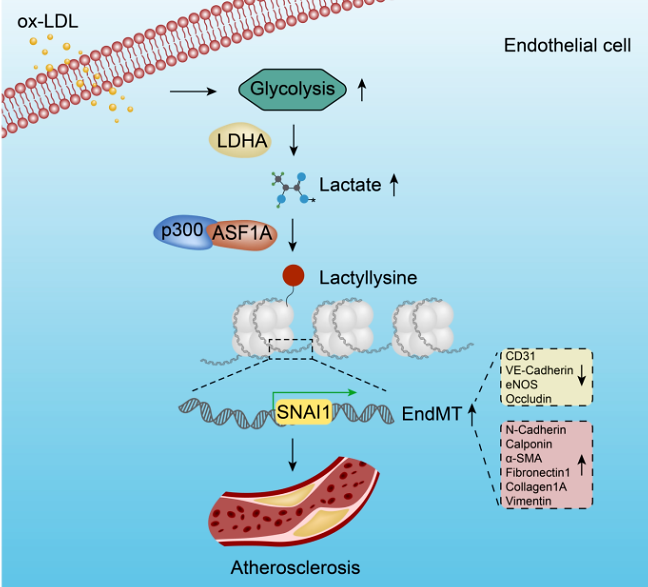
Model:Histone chaperone ASF1A and P300 together regulate histone H3 lysine 18 lactylation,
which increases the expression of the endothelial-to-mesenchymal transition
transcription factor SNAI1, inducing endothelial dysfunction and promoting
atherosclerosis.
原文链接:https://www.sciencedirect.com/science/article/pii/S2211383524000893
(撰稿/董梦蝶;审核/陈宏山)


